Результати дослідженнь та їх обговорення
Результати проведеного дослідження показали, що початкові етапи регенерації супроводжуються зниженням загального рівня колагену (визначеного за рівнем гідроксипроліну). Зокрема, рівень гідроксипроліну на 24 годину після гепатектомії в досліджуваних зразках тканин печінки знижується в 1,4 рази порівняно з вихідними показниками нульового часу (Рис. 3.1.).
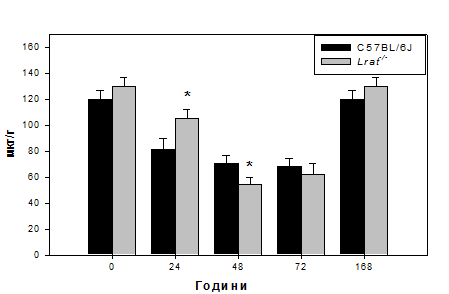
Рис. 3.1. Рівень гідроксипроліну в печінці мишей дикого типу (C57BL/6J) та нокаутів Lrat-/- після гепатектомії.
Примітка: величини подані як M±m, n = 5; «*» - статистично достовірна різниця порівняно з показниками мишей C57BL/6J (P ≤ 0,05).
Якісний аналіз фракційного складу колагенових фібрил засвідчив зниження частки усіх без винятку фракцій колагену в досліджуваних зразках (Рис.3.2.). Виявлена тенденція до зниження рівня колагену спостерігалась протягом перших трьох діб після проведеної ЧГЕ, при цьому найнижчий рівень колагену виявлявся в часовому проміжку, що відповідає 3-ій добі (72 години) після проведеної гепатектомії.
Встановлена динаміка виявляється цілком закономірною з огляду на необхідність повноцінного відтворення структури паренхіми печінки. Цей процес в першу чергу полягає в протеолізі наявного позаклітинного матриксу, з метою підвищення мобільності клітин печінки.
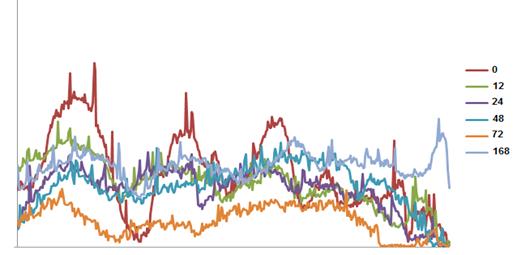
Рис.3.2. Електрофоретичні профілі екстрагованої колагенової фракції печінки мишей дикого типу (C57BL/6J) після гепатектомії.
Примітка: денситограми фракційного складу колагену печінки позначено різними кольорами у відповідності до часового проміжку.
Протягом ініціації відновлення паренхіми печінки відбувається формування аваскулярних кластерів, утворених гепатоцитами та стелатними клітинами печінки. Надзвичайно важливим виявляється міграція стелатних клітин в такі кластери з їх наступною адгезією та формуванням щільних клітинних контактів з гепатоцитами [17-19]. У зв’язку з цим усунення топологічних перешкод у міграції клітин у вигляді інертного ПКМ шляхом його протеолізу виявляється цілком закономірним [17]. Цей процес опосередковується дією спеціалізованої групи більш ніж 20 протеїназ відомих як матриксні металопротеїнази (MMП). Особливої уваги заслуговують інтерстиційні колагенази (MMП-1, -8, -13), що виявляються єдиними металопротеїназами здатними розщеплювати нативні калагени I і III та їх триспіральні домени, забезпечуючи зниження жорсткості структури ПКМ.
Висловлене припущення підтверджується отриманими нами даними, щодо підвищення рівня вільного гідроксипроліну в сироватці крові дослідних тварин (Рис. 3.3.). Рівень цієї амінокислоти, утвореної внаслідок потрансляційних модифікацій проколагенових поліпептидних ланцюгів та вивільненої при протеолізі колагену, зростає більш ніж у 2 рази, досягаючи своїх максимальних значень вже на 12 годину після проведеної часткової гепатектомії.
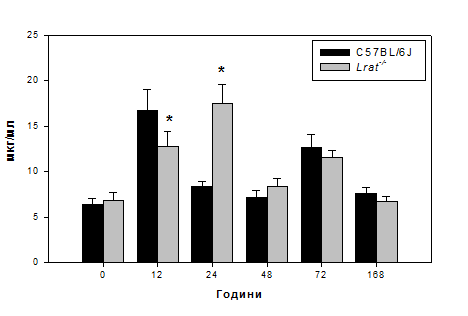
Рис. 3.3. Рівень вільного гідроксипроліну в сироватці мишей дикого типу (C57BL/6J) та нокаутів Lrat-/- після гепатектомії.
Примітка: величини подані як M±m, n = 5; «*» - статистично достовірна різниця порівняно з показниками мишей C57BL/6J (P ≤ 0,05).
Водночас в печінках мишей Lrat-/- спостерігається деяке уповільнення деструкції колагенової компоненти ПКМ. Зокрема на 24 годину при збереженні тенденції до зниження кількості колагену рівень його в печінці цієї групи на 28% перевищує даний показник в групі тварин з нормальним збереженням вітаміну А (Рис.3.1.). При цьому електрофоретичний аналіз колагенових фракцій вказує на зниження частки мономерних колагенових фібрил при збереженні фракції зрілих тримерів колагену (Рис. 3.4.).
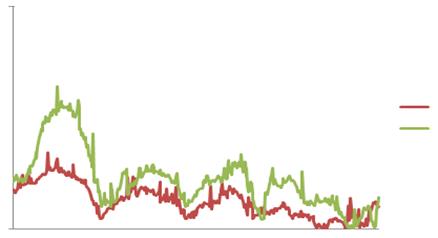
Рис.3.4. Електрофоретичні профілі екстрагованої колагенової фракції печінки мишей дикого типу (C57BL/6J) та Lrat-/- на 24 годину після гепатектомії.
Неможливістю повноцінного протеолізу тримерів, значна частка яких виявляється нами на електрофореграмах при якісному аналізі колагенових фракцій, можна пояснити підвищений рівень колагену в печінці групи ноакутних тварин позбавлених ретинілефірів та ліпідних крапель стелатних клітин. Отримані результати узгоджуються з даними літератури щодо перешкоджання повноцінної регенерації в умовах порушення протеолітичної деградації колагену І [27]. Водночас порушення протеолізу колегену на початкових етапах регенерації інгібує проліферацію клітин печінки, в тому числі і стелатних клітин. Дослідження in vitro засвідчили, що накопичення інтерстиційних фібрилярних колагенів здатне впливати на проліферацію, виживання та синтетичну активність клітин печінки, включаючи ендотеліальні клітини, гепатоцити та стелатні клітини. Крім того інтактний колаген є слабким лігандом до зв’язування сигнальних молекул типу інтегринів, в той час як частково деградовані зрілі ланцюги виступають сайтами зв’язування цих молекул і активаторами проліферації гепатоцитів [1].
Подібні статті
Особливості будови і біології павуків
Актуальність:
павуки в наш час є однією з найбільш процвітаючих груп тварин. Вони освоїли всі
природні зони Землі - від пустель і тропічних лісів до помірних областей
Найбільш
значущою ознакою павуків, яка відрізняє їх від інших, є паву ...
Рослинність евтрофних боліт
Актуальність. В епоху широкомасштабного впливу людської
цивілізації на навколишнє середовище проблема вивчення закономірностей
генезису, динаміки боліт і заболочених земель як важливого біоенергетичного
компонента та носія значного обсягу ...
