Електронномікроскопічні дослідження апікальних меристем картоплі та вплив хіміотерапії на процес оздоровлення
Досліджували 2 концентрації нових речовин - 0,1 і 0,05 г/л, використовуючи двофазну дію: у першу фазу витримували частинки зелених пагонів картоплі в рідкому розчині антивірусних речовин протягом 2 діб; у другу фазу виділяли експланти розміром 300 - 500 мкм і висаджували їх на поживне середовище з додаванням АВР.
Як контроль під час порівняння ефективності антивірусної дії використовували антивірусний комплекс, який складався із 2,4-діоксогекса-гідро-1.3,5-триазину (ДГТ), ціаногуанідину і розгалуженого манану (РМ) - полісахариду, виділеного із дріжжів роду Candida sp. (клітинні дріжжові манани).
Проводили комплексне тестування отриманих ліній рослин-регенерантів, використовуючи методи імуноферментного аналізу, електронної мікроскопії і рослин-індикаторів.
Електронномікроскопічні дослідження ультратонких зрізів меристемних тканин картоплі дають певне уявлення про розвиток вірусної інфекції в них, а також можливість виявити деякі деталі механізму розвитку інфекції.
При вивченні меристем досліджували такі питання: характер будови та ультраструктурну організацію клітин меристематичної тканини картоплі по зонах; наявність плазмодесм в клітинах на різних рівнях; розподіл і спосіб локалізації вірусних включень у меристематичних клітинах.
Деталі ультраструктурної організації меристемних клітин були встановлені на прикладі сорту Приєкульська рання. В результаті проведених досліджень серій ультратонких зрізів встановлено, що меристемні тканини в зоні 10-15 мкм від верхівки складаються з клітин без вакуолей, цитоплазма має рівномірний гомогенний матрикс із слабо диференційованими клітинними органелами. Починаючи з зони 20-30 мкм вже спостерігається диференціація клітинних органоїдів. З'являються вакуолі, матрикс ядра більш просвітлений. Характерним для цих ділянок тканин є наявність у вакуолях більшості периферійних клітин порівняно великих глобулярних тіл, можливо, саме там накопичуються в клітині рістактивуючі речовини (рис. 2). Ядерця в клітинах, як правило, мали центральні просвітлені зони, які не спостерігалися в ядерцях звичайної листової тканини.
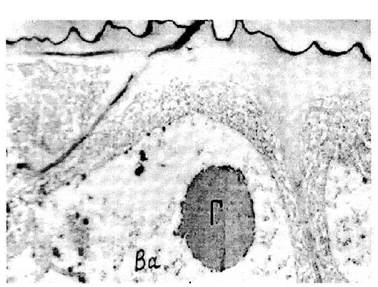
Рис. 2. Глобулярні включення у вакуолях меристематичних клітин. Зона розміром близько 30 мкм від верхівки. Ва - вакуоль, Г - глобули. Збільшення -19000.
Особливий інтерес для розуміння механізм)' проникнення вірусів у клітини меристемних тканин викликає процес формування плазмодесм, які є своєрідними каналами розповсюдження вірусів у звичайних рослинних тканинах. Відсутністю плазмодесм окремі дослідники пояснюють відсутність вірусу в меристемній тканині [9].
Дослідження показали, що перші плазмодесми, ще не зовсім сформовані, виявляються вже в зоні близько 30 мкм, добре сформовані плазмодесми виявляли в зоні близько 60 мкм.
Із всіх досліджених вірусів досить легко виявляли МВК в меристематичних тканинах, починаючи із зони 80-90 мкм. Локалізація вірусних включень є доволі різною: загальною тенденцією є те, що віруси зустрічаються здебільшого біля ядра. Форма і розмір вірусних включень теж різні, від невеликих включень, до масових. Потрібно відмітити здатність М-вірусу утворювати кристалічні структури по типу паракристалів (рис.3). Як правило, такий спосіб локалізації в клітині характерний для жорсткопа-личкоподібних вірусів і, зокрема, для вірусу тютюнової мозаїки.
Подібні статті
Біоморфологічні особливості та cхожість насіння Leontopodium alpinum Cass
Флора високогір’я Українських Карпат характеризується високим ступенем ендемізму та рідкісності. Переважна більшість ендемічних та рідкісних видів сформована з малочисельних популяцій. Дослідження стратегії малочисельних популяцій цих видів пов ...
Сезонні зміни в житті безхвостих, пов’язані з особливостями їх біології (жаби, ропухи)
Поведінка земноводних нескладна, що відповідає організації центральної
нервової системи. Частина безхвостих здатна до швидких, але одноманітним рухам;
у воді більшість видів більш рухливі, чим на суші. Основа поведінки земноводних
- порівн ...
