Структура і механізм дії ферментів
Активність ферментів визначається їхньою тривимірною структурою. В ранніх дослідженнях було отримано багато доказів того, що ферменти – це білки. Нездатність проходити крізь напівпроникну мембрану, особливості їх розчинності, денатурація при нагріванні і в сильному лужному чи кислотному середовищі – всі ці властивості ферментів співпадають зі звичайними характеристиками білків. В наш час багато ферментів отримано в чистому вигляді та проаналізовано їх будову. У всіх випадках доведено, що вони являють собою білки. Як і всі білки, ферменти синтезуються у вигляді лінійного ланцюжка амінокислот, який згортається певним чином. Кожна послідовність амінокислот згортається особливим чином, і молекула (білкова глобула), що виходить, володіє унікальними властивостями. Кілька білкових ланцюжків можуть об'єднуватися у білковий комплекс.(Рис.1) Найбільші рівні структури білків — третинна та четвертинна структури — руйнуються при нагріванні або під дією деяких хімічних речовин.
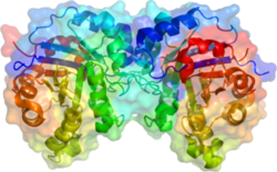
Рис.1. Просторова структура тріозфосфат-ізомерази
Щоб каталізувати реакцію, фермент повинен зв'язатися з одним або кількома субстратами. Білковий ланцюжок ферменту згортається таким чином, що на поверхні глобули утворюється щілина або западина, до якої приєднуються молукули субстрату. Ця область називається ділянкою (сайтом) зв'язування субстрата. Зазвичай вона співпадає з активним центром ферменту або знаходиться поблизу від нього. Деякі ферменти містять також ділянки зв'язування кофакторів або іонів металів.
У деяких ферментів присутні також ділянки зв'язування малих молекул, що не беруть безпосередньої участі в реакції і часто, але не обов'язково, є субстратами або продуктами метаболічного шляху, в який входить фермент. Вони зменшують або збільшують активність ферменту, що створює можливість для зворотного зв'язку або регуляції роботи ферменту.Для активних центрів деяких ферментів характерне явище кооперативності.
Специфічність
Одна з найбільш характерних властивостей ферментів – це їх специфічність, в міру якої кожен фермент діє тільки на одну речовину або дуже невелику кількість споріднених речовин. Специфічність дії ферментів – найважливіше біологічне явище, без якого неможливий впорядкований обмін у живій природі, відповідно і саме життя. Концентрація каталізатора – розмір його активної поверхні – визначає швидкість змін, що відбуваються під його впливом. Високо специфічні каталізатори визначають які саме речовини підлягають перетворенню. Специфічність каталізаторів завдяки своїй структурі визначає серед багатьох шляхів той єдиний шлях, за яким повинна йти реакція. Він має здатність направляти реакцію по одному шляху. Цю напрямленість надають процесам обміну внутрішньоклітинні ферменти. Якщо б ферменти на мали специфічності, їх дія призводила б до швидкого розпаду клітинного матеріалу і при цьому не відбувалося б біосинтезу.
Ступінь специфічності у різних ферментів варіює. В більшості випадків фермент діє тільки на одну речовину і каталізує лише одну реакцію. В інших випадках фермент може діяти на ряд близькоспоріднених речовин, каталізуючи кожен раз одну й ту ж саму реакцію. Ферменти демонструють високий рівень стереоспецифічності (просторової специфічності), регіоселектівності (специфічності орієнтації) і хемоселектівності (специфічності до хімічних груп).
Подібні статті
Загальна характеристика миші-крихітки
Гризуни
- клас ссавців, який досяг великого успіху і здатний адаптуватися до різних
умов. До нього належить більше 40 відсотків всіх видів ссавців. Вони
зустрічаються по всьому. Незважаючи на різноманітність способу життя та
середовища іс ...
Біологічна роль марганцю в організмі людини і тварин
Вчення про біологічну роль хімічних елементів, що містяться в тканинах
організму в дуже невеликих концентраціях (від 10-3 до 10-12 %)
і тому одержали назва мікроелементів, виділилося в самостійну науку порівняно
недавно. Майже до кінця XІ ...
